- Категория: Блог
- Просмотров: 212
Гиперспектральное дистанционное зондирование является современным передовым этапом технологии дистанционного зондирования, использование множества очень узких диапазонов электромагнитных волн от интересующего объекта для получения соответствующих данных, содержит богатство пространственной, радиометрической и спектральной тройной информации, разработка которой является революцией в дистанционном зондировании, но также вызвала фундаментальные изменения в методах обработки данных и анализа информации, так что оригинал в широкополосном дистанционном зондировании в необнаруживаемом материале, в гиперспектральном дистанционном зондировании может быть обнаружен. Так что же такое гиперспектральный? Он начинается с видимого диапазона солнца.
Почему мир такой красочный?
Будь то юг неба или смена сезонов, почему мы чувствуем, что мир такой красочный? Радуга, которая проясняется после дождливого дня, может помочь нам найти ответ. Солнечный свет на самом деле является смешанным светом, через рассеивание капель воды в воздухе разлагается на красочный монохроматический свет, составляющий все цвета, которые могут воспринимать наши глаза, эта часть света определяется как видимые длины волн солнца.
В дополнение к этому солнечный свет также содержит свет в ультрафиолетовых и инфракрасных длинах волн. Однако тот же цвет света для наших человеческих глаз также является сложным цветом света, содержащим тысячи полос, что находится далеко за пределами предела человеческого глаза, чтобы различать. В то же время разные объекты состоят из разных элементов и их соединений, структура материала также различна, что приводит к тому, что длина волны отраженного или рассеянного света на поверхности объекта также показывает специфику; разные объекты в разных состояниях с разными длинами волн света отражают или рассеивают разную способность, но также делают объект имеющим разный цвет или спектральные характеристики, как и «отпечатки пальцев». Подобно информации «отпечатков пальцев», она может различать особенности и состав атмосферы тонким способом. Такие уникальные спектральные характеристики веществ составляют основу для идентификации и анализа характеристик различных объектов в науке дистанционного зондирования.
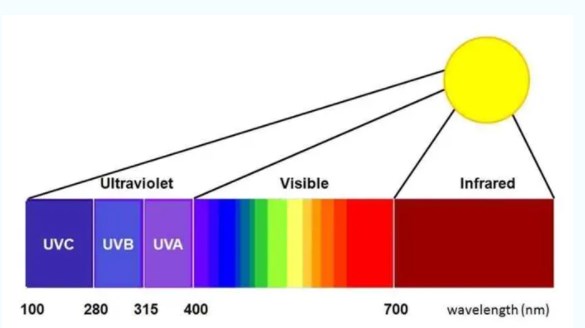
Для точного получения световой информации в различных диапазонах длин волн оптические дистанционные датчики спутников последовательно приняли технологию многоспектральной визуализации и технологию гиперспектральной визуализации, в которой свет, отраженный или рассеянный от объектов, разделяется на определенные диапазоны длин волн света с помощью фильтров, призм, решеток и других устройств для разделения света, а цели идентифицируются, а дистанционное зондирование количественно оценивается на основе информации о спектральных характеристиках, полученной с земли или от атмосферного отражения или рассеивания.
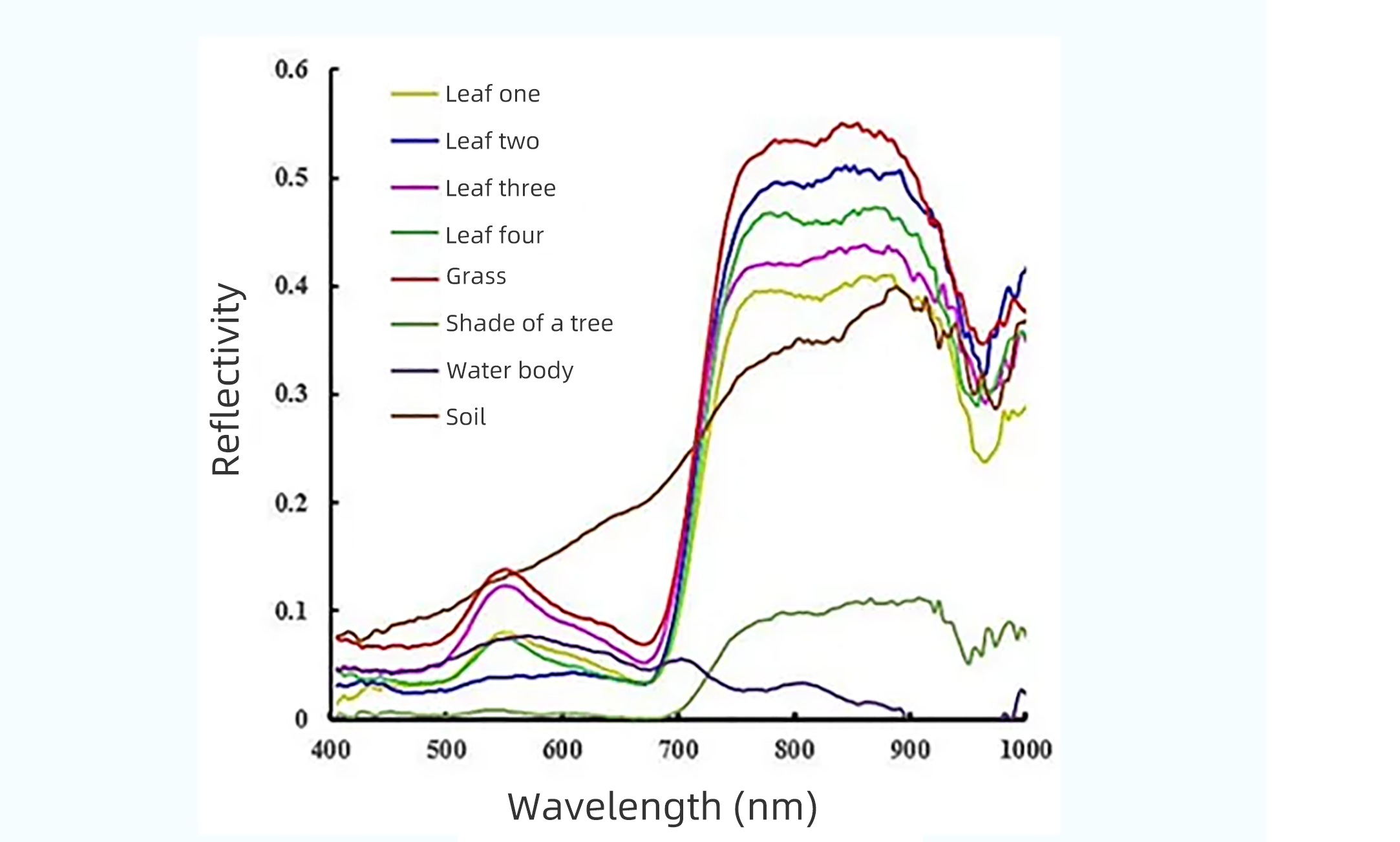
Первоначально дистанционное зондирование земли использовало систему технологии многоспектральной визуализации, часто всего с несколькими каналами, каждый канал содержит оптическую информацию с длинами волн шириной в десятки нанометров и может реализовать спектральную способность обнаружения как в инфракрасном, так и в ультрафиолетовом направлениях. Однако для схожих объектов или объектов в разных состояниях характерные пики их спектров отражения обычно схожи, как показано на рисунке ниже, характерные пики четырех видов деревьев лишь немного отличаются на 960 нанометрах, и для того, чтобы различать категории разных видов деревьев, требуется спектральное разрешение менее десяти нанометров; например, для классификации и идентификации горных пород, появления вредителей и болезней сельскохозяйственных культур, восстановления почвы для сельского хозяйства и вспышек флоры или цианобактерий, например, для классификации и идентификации горных пород, вредителей и болезней сельскохозяйственных культур, восстановления и обработки почвы, цветения воды или вспышек цианобактерий, загрязнения воздуха и других проблем, которые отражаются в спектрах только при изменении в несколько нанометров, традиционные средства многоспектрального обнаружения перегружены, и процент успешной идентификации невысок.
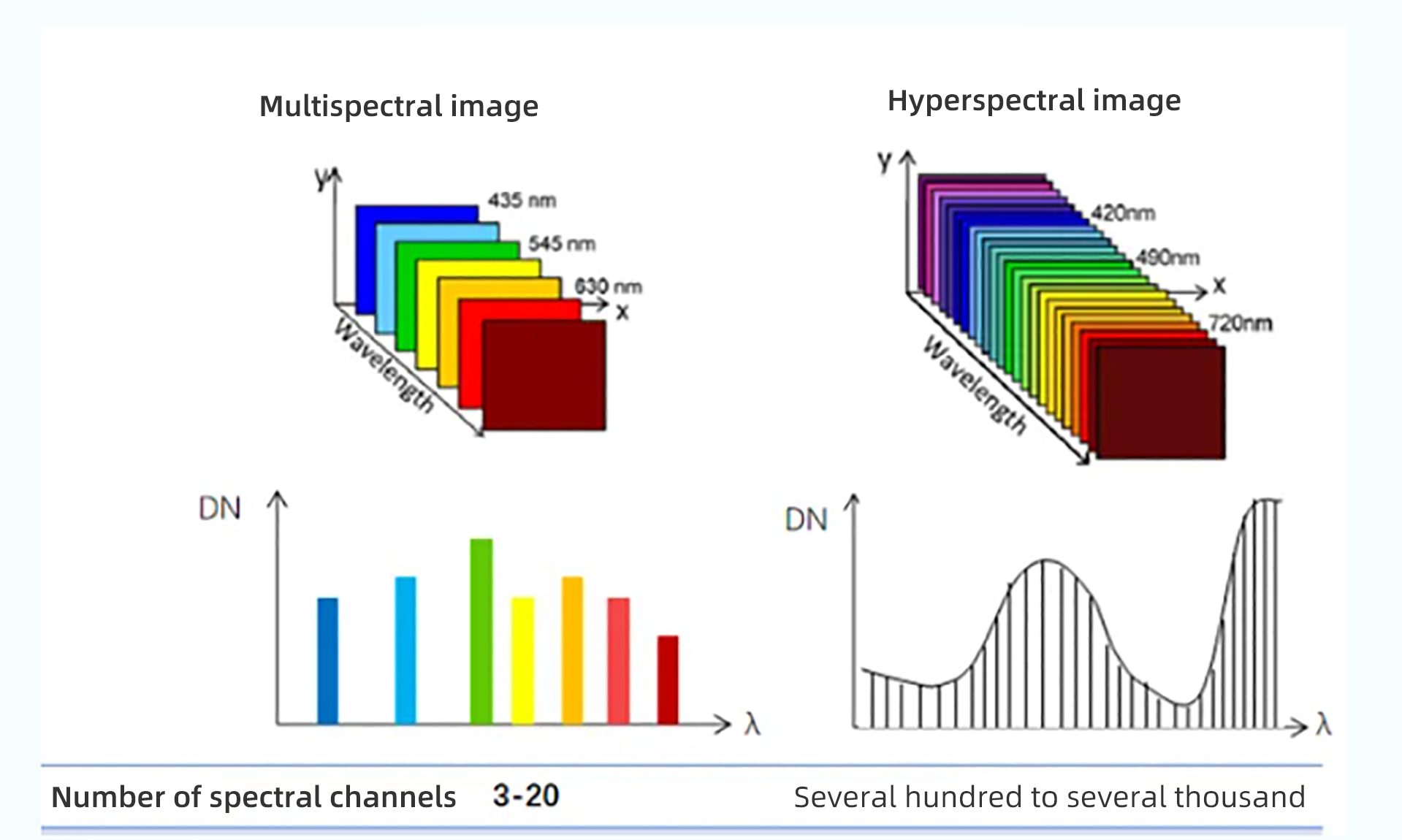
 С началом разработки гиперспектральной технологии дистанционного зондирования в 1970-х годах область оптического дистанционного зондирования претерпела революционные изменения и постепенно сформировала популярную область передовых технологий. Гиперспектральная технология дистанционного зондирования - это технология, основанная на очень многих узкополосных данных изображения, которая объединяет технологию визуализации со спектральной технологией для обнаружения двумерного геометрического пространства и одномерной спектральной информации цели, а также для получения непрерывных узкополосных данных изображения с высоким спектральным разрешением. Технология гиперспектральной визуализации быстро развивается, и к распространенным из них относятся решеточная спектроскопия, акустооптическая спектроскопия с перестраиваемым фильтром, призменная спектроскопия и покрытие чипа.
С началом разработки гиперспектральной технологии дистанционного зондирования в 1970-х годах область оптического дистанционного зондирования претерпела революционные изменения и постепенно сформировала популярную область передовых технологий. Гиперспектральная технология дистанционного зондирования - это технология, основанная на очень многих узкополосных данных изображения, которая объединяет технологию визуализации со спектральной технологией для обнаружения двумерного геометрического пространства и одномерной спектральной информации цели, а также для получения непрерывных узкополосных данных изображения с высоким спектральным разрешением. Технология гиперспектральной визуализации быстро развивается, и к распространенным из них относятся решеточная спектроскопия, акустооптическая спектроскопия с перестраиваемым фильтром, призменная спектроскопия и покрытие чипа.
Каковы технические характеристики гиперспектрального дистанционного зондирования?
Гиперспектральная (гиперспектральная камера) одноканальная полоса пропускания узкая, ее спектральное разрешение достигает порядка нанометра (нм) (обычно менее 10 нм), количество спектральных каналов достигает десятков или даже сотен, что позволяет получать непрерывные спектральные данные по отражению/рассеиванию материала, которые могут быть реализованы в диапазоне видимого, ближнего инфракрасного, среднего инфракрасного и теплового инфракрасного диапазонов длин волн, а также получать гиперспектральные данные.
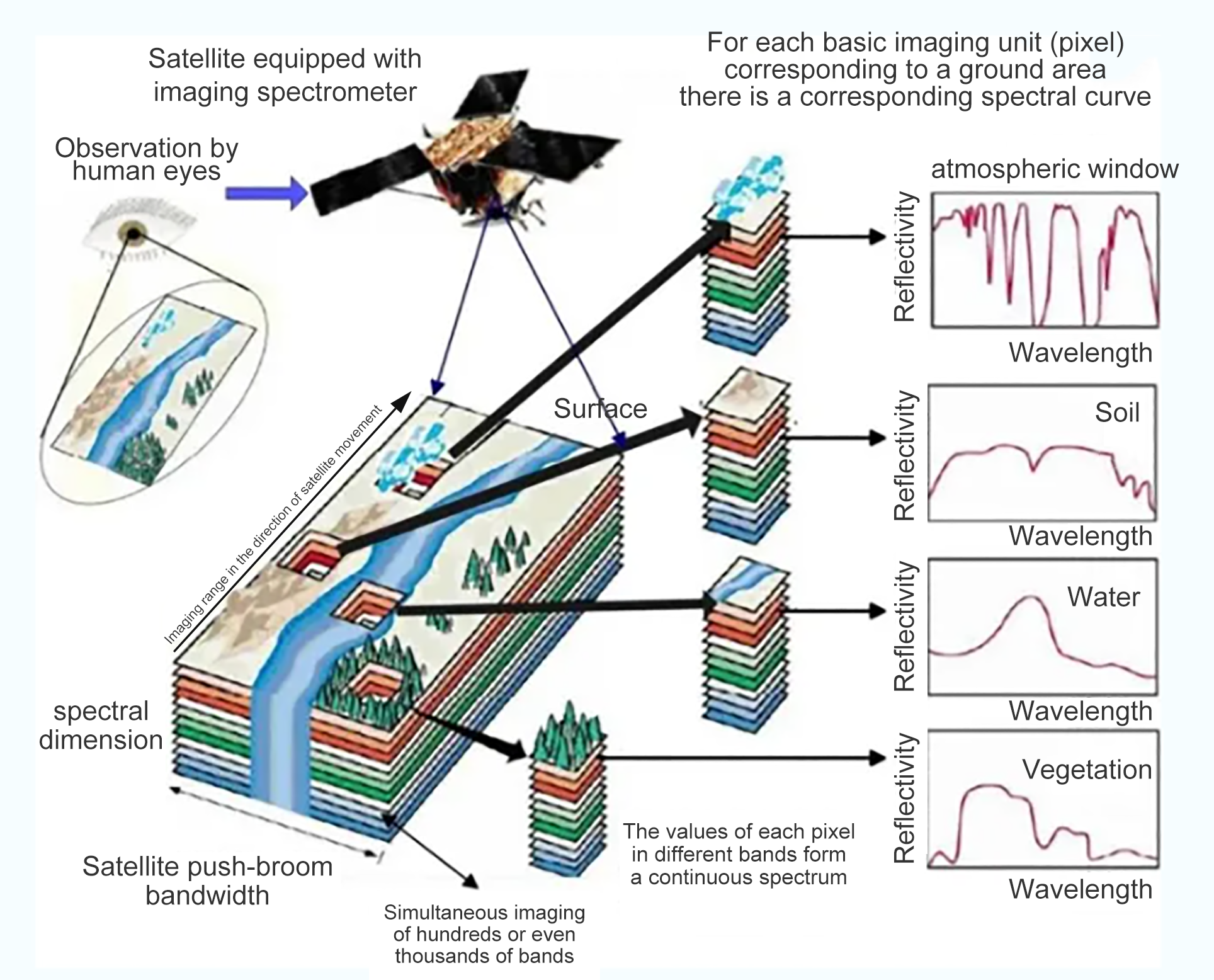
В отличие от традиционной технологии многоспектрального дистанционного зондирования, которая различает цели на основе цветовых различий, технология гиперспектрального дистанционного зондирования может достигать дискретной выборки в спектральном пространстве, и цели, которые можно различить, как правило, те, которые имеют очевидные различия в спектральном пространстве, такие как водоемы, растительность и голая земля. Гиперспектральное дистанционное зондирование представляет собой технологию получения многомерной информации, которая объединяет технологию визуализации и спектральную технологию, которая может одновременно получать двумерную пространственную информацию о цели и трехмерную спектральную информацию, и анализировать информацию о составе материала через морфологию спектральных кривых для идентификации цели, а также целевых особенностей, которые могут различать различные категории одного и того же типа особенностей. В соответствии с различными сценариями применения, селективность спектра становится гибкой и разнообразной, что улучшает способность различать и идентифицировать признаки, эффективно различает различные категории, принадлежащие к одному и тому же виду признаков, реализует «различные спектры для одного и того же вида признаков» и «различные признаки для одного и того же вида спектра» и уменьшает явление спектрально-пространственной путаницы признаков, такое как явление разных видов деревьев. Это может уменьшить явление спектрально-пространственной путаницы признаков, такое как идентификация разных видов деревьев и разных минералов; в то же время гиперспектральные данные могут использоваться для извлечения биофизических и химических параметров и биохимического анализа хлорофилла а, лигнина и целлюлозы растительности.
Развитие технологии гиперспектрального дистанционного зондирования превращает дистанционное зондирование из качественного анализа в количественное или полуколичественное преобразование. Основное применение традиционной технологии дистанционного зондирования с получением изображений основано на качественном анализе. Часть результатов количественного анализа точности результатов не идеальна, что, очевидно, связано со спектральным и пространственным разрешением датчика изображения, помехами атмосферного и почвенного фона и другими ограничениями. Дистанционное зондирование с получением изображений с гиперспектральным разрешением впервые преодолевает ограничение спектрального разрешения, что в значительной степени подавляет влияние других мешающих факторов в спектральном пространстве, что очень полезно для повышения точности результатов количественного анализа.
Что такое гиперспектральные приложения?
По сравнению с изображениями высокого разрешения и многоспектральными изображениями гиперспектральные изображения имеют высокое спектральное разрешение и множество полос, которые могут получать почти непрерывные спектральные кривые признаков, и конкретные полосы могут быть выбраны или извлечены в соответствии с необходимостью выделения целевых признаков; квантованные данные непрерывной спектральной кривой обеспечивают условия для введения классификации изображений в модель спектрального механизма признаков, которая содержит богатую радиометрическую, пространственную и спектральную информацию и является синтезом разнообразной информации. Она содержит богатую радиометрическую, пространственную и спектральную информацию и является всеобъемлющим носителем различной информации. Гиперспектральные изображения широко используются в областях геоморфологического картирования, разведки ресурсов, сельскохозяйственного дистанционного зондирования, экологического дистанционного зондирования, мониторинга лесного хозяйства, дистанционного зондирования почв, дистанционного зондирования цвета воды и атмосферной науки.
1. Дистанционное зондирование для классификации объектов
На рисунке показаны гиперспектральные данные прибрежной зоны Дубая, полученные с помощью гиперспектральных дистанционных датчиков, которые могут точно распознавать информацию об основных категориях объектов, таких как водоемы, здания, дороги, голая почва и т. д., посредством классификации объектов, и могут быть подразделены на 3–5 эффективных подкатегорий в каждой основной категории, а также могут распознавать информацию о судах в отдаленном море.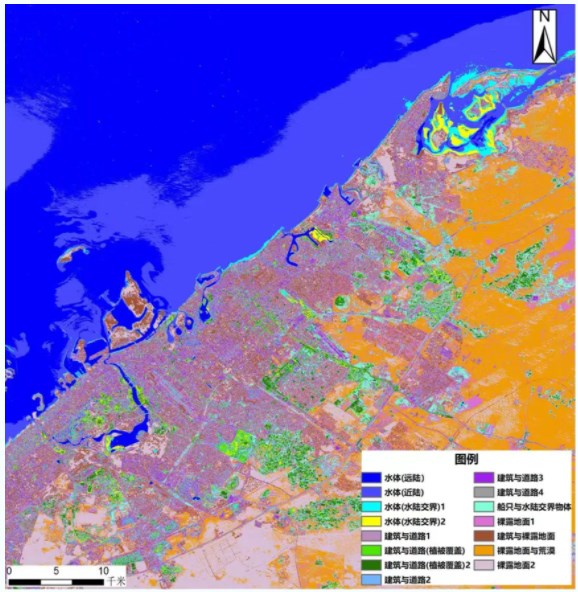
2. Разведка рудных месторождений
Технология гиперспектрального дистанционного зондирования может дать толчок геологической разведке. На основе анализа спектральных кривых полученных пород можно узнать типы распределения минералов и площадь места. На рисунке показано, что данные гиперспектрального дистанционного зондирования эффективно извлекли два вида минеральной информации о сериците и хлорите в районе Дулан провинции Цинхай, а после преобразования MNF они улучшают распознавание литологической и тектонической геологической информации.

3. Дистанционное зондирование водной среды
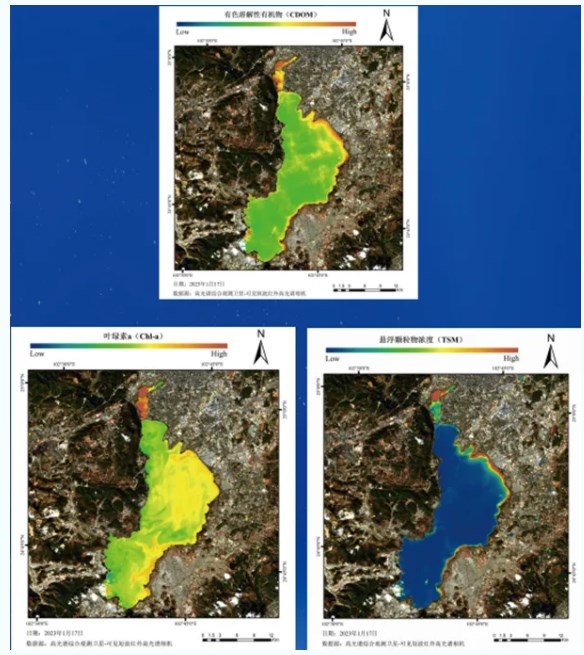
Из-за определенного сходства между спектрами водных растений и цветения воды и спектрами растительности, для обычно используемых многоспектральных данных дистанционного зондирования сложно точно идентифицировать цветение воды и водные растения, и только гиперспектральные данные дистанционного зондирования могут улавливать подробные спектральные различия между сложными и изменчивыми цветениями воды, водными растениями и водоемом, чтобы точно идентифицировать цветение воды и водные растения. На рисунке показана экологическая карта регионального водоема Юньнань Дяньчи, полученная с помощью спутникового гиперспектрального дистанционного датчика, который может четко определять окрашенное растворенное органическое вещество (CDOM), хлорофилл a (Chl-a) и концентрацию взвешенных твердых частиц (TSM) в водоеме. Между тем, параметры качества воды малых рек и озер, отличных от Дяньчи, также четко распознаются на изображении.
4. Дистанционное зондирование атмосферы
Дистанционный мониторинг выбросов метана из точечных источников проводился в Ливии и США с использованием гиперспектральных данных дистанционного зондирования с оптимизированными алгоритмами инверсии концентрации метана в столбе. На рисунке (a) показаны результаты мониторинга утечки метана из нефтяной скважины Dor Marada в Ливии, а на рисунке (b) показаны результаты мониторинга утечки метана из нефтяной скважины DCP Midstream в Пермском бассейне США, которая может точно контролировать чистый шлейф выбросов метана в регионе.

- Категория: Блог
- Просмотров: 247
Спектральный, мультиспектральный, гиперспектральный, не можете заметить разницу?

Спектральный анализ как важное средство естественнонаучного анализа, спектральная технология часто используется для обнаружения физической структуры объектов, химического состава и других показателей. Спектрометрия изображений, с другой стороны, объединяет спектральную технологию и технологию визуализации, объединяя спектральное разрешение и графическое разрешение, что приводит к многогранному спектральному анализу в пространственном измерении, который теперь известен как технология мультиспектральной визуализации и гиперспектральной визуализации.
В чем разница между спектральным, мультиспектральным и гиперспектральным?
Спектр
Спектр — это монохроматический свет, разделенный дисперсией после дисперсионной системы (например, призмы, решетки), через систему формирования изображений, проецируемый на детектор, чтобы стать размером длины волны (или частоты) последовательного расположения рисунка, который известен как оптический спектр. Спектрометр Ocean Optics основан на этом принципе проектирования и производства.
В зависимости от длины волны световые волны имеют разные названия: длины волн в диапазоне 380 и 780 нм называются видимым светом, волны короче 380 нм называются ультрафиолетовым светом, а волны длиннее 780 нм называются инфракрасным светом (инфракрасный свет также делится на ближний инфракрасный, средний инфракрасный, дальний инфракрасный и т. д.).
Мультиспектральный
Мультиспектральная технология относится к одновременному получению нескольких оптических спектральных диапазонов (обычно больше или равно 3), а также в видимом свете на основе инфракрасного света и ультрафиолетового света для расширения направления технологии спектрального обнаружения. Обычный метод реализации заключается в использовании различных фильтров или светоделителей и различных комбинаций фотопленки, чтобы в то же время, соответственно, получать одну и ту же цель в диапазоне различных узких спектральных диапазонов излучаемых или отражаемых световых сигналов, чтобы получить цель в нескольких различных спектральных диапазонах фотографии. Наиболее распространенными мультиспектральными фотографиями являются те, которые сделаны цветными камерами, как показано ниже, которые содержат информацию в трех оптических спектральных диапазонах, красном (1), зеленом (2) и синем (3), со спектральной точки зрения. Если к камере или детектору добавить больше диапазонов, таких как диапазоны (4) и (5), можно получить мультиспектральный снимок с несколькими диапазонами.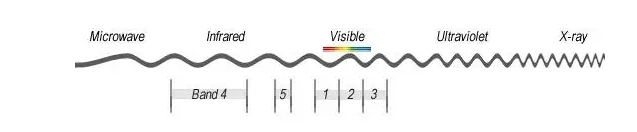
Мультиспектральная технология в сочетании с оборудованием для формирования изображений позволяет представлять мультиспектральную информацию в виде изображения.
Конечно, также возможно использовать только детектор для получения спектральной информации одной пространственной точки. Pixelteq, бренд Ocean Optics, с его уникальной технологией фильтрации чипов, может реализовать получение 8 каналов спектральной информации на чипе размером 9*9 см, что особенно подходит для приложений с чрезвычайно высокими требованиями к пространству и стоимости.
Гипеспектральный
Гиперспектроскопия — это тонкая технология, которая позволяет захватывать и анализировать спектры по точкам в пространственной области благодаря уникальным спектральным «особенностям», которые можно обнаружить в различных пространственных точках одного объекта, и, следовательно, может обнаруживать вещества, которые невозможно различить визуально.
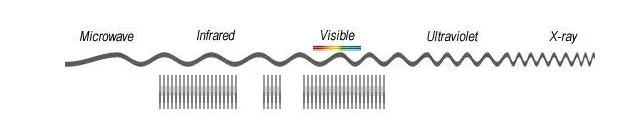
Пример гиперспектрального изображения: изображения состоят из более узких полос (10-20 нм). Гиперспектральные изображения могут иметь сотни или тысячи полос. После того, как объект взаимодействует со светом от источника света и принимается невизуальным спектральным анализирующим устройством (например, спектрометром), устройство может точно реагировать на различия в интенсивности распределения принятого светового сигнала по спектральным полосам, также известным как спектральная информация. При использовании гиперспектрального оборудования, с точки зрения характеристик изображения, вы можете понять спектральную информацию каждой позиции образца, с точки зрения спектральных характеристик, вы можете понять распределение позиции сигнала в определенной спектральной полосе, то есть гиперспектральное оборудование может получить более богатую подробную информацию. Например: человеческий глаз может воспринимать только три спектральные полосы в сигнале световой энергии объекта: красный, зеленый и синий. То есть, мы часто называем это тремя основными цветами, но на самом деле мы можем видеть комбинацию этих трех цветов, создаваемую оранжевым, фиолетовым, лаймово-зеленым и так далее более тонкими цветами. Однако мы не можем различить разницу между чистым желтым и смесью красного и зеленого, которая также известна как «изохроматическая». Но гиперспектральная визуализация может легко различить разницу.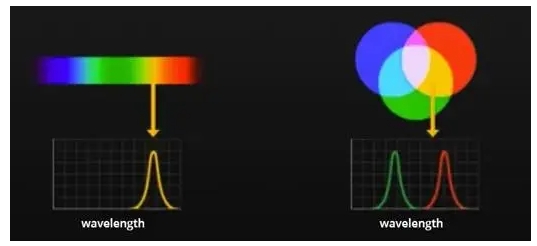
Выше два желтых цвета, один «сплошной цвет», а другой — смесь красного и зеленого, могут быть визуально неразличимы, но из-за их спектральных различий их можно различить с помощью спектроскопического оборудования. В наших экспериментах данные, полученные с помощью спектрометра, представляют собой среднее значение света, испускаемого всеми молекулами, взаимодействующими с источником падающего света во всем обнаруженном диапазоне, тогда как с помощью многоспектрального устройства можно получить информацию об образцах в нескольких определенных полосах в различных точках в пределах обнаруженного диапазона. В результате ни одно из этих устройств не может предоставить очень точную информацию об образце в одной области.
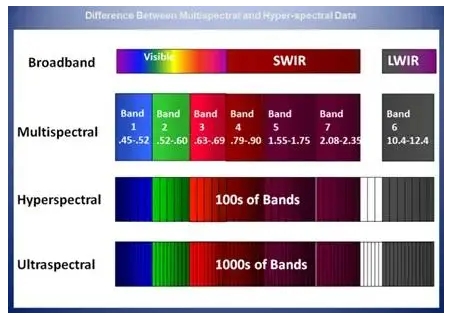
Гиперспектральный формирователь изображений (HSI) можно сравнить с сотнями или тысячами одноточечных спектрометров, выстроенных в ряд и одновременно фокусирующихся на области, при этом каждый спектрометр работает независимо и получает спектральную информацию о своем собственном местоположении. Выходные данные HSI представляют собой изображение или видеопоток, в котором каждый пиксель имеет свой собственный спектр, а каждый спектр содержит сотни спектральных полос. Эта «полноспектральная» возможность гиперспектральной визуализации позволяет видеть спектральные сигналы в каждом различимом пространственном месте сцены, т. е. получается больше размерной информации. Таким образом, гиперспектральную визуализацию можно использовать в различных приложениях, включая идентификацию произведений искусства, здоровье сельскохозяйственных культур, картографирование береговой линии, лесное хозяйство, разведку полезных ископаемых, городскую и промышленную инфраструктуру, качество продукции на производственных линиях, мониторинг окружающей среды и многое другое.
Методы гиперспектрального сканирования и результаты визуализации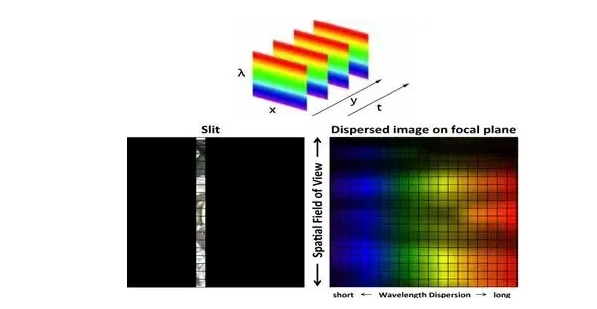
Разница между гиперспектральным и мультиспектральным
Очень часто спектр отражательной способности материала может быть очень сложным по отношению к длине волны, и другие мельчайшие особенности могут быть неразличимы с помощью более грубых методов многоспектральной визуализации.
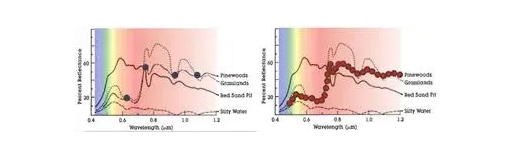
Вещества, которые были неотличимы от тех, которые были идентифицированы с помощью мультиспектральной визуализации (слева) на рисунке выше, были различены с помощью гиперспектральной визуализации (справа). Причина этого в том, что поскольку гиперспектральная визуализация имеет больше спектральных полос, более сложные признаки отпечатков пальцев могут быть точно получены с более высоким спектральным разрешением.
Типичные применения
Гиперспектральные устройства могут обнаруживать определенные краски или красители в инфракрасном диапазоне, которые не видны человеческому глазу. Аналогично, системы HSI в диапазоне 60 или 300 могут предоставить более богатую спектральную информацию об отражательной способности материала, чем многоспектральная система, что позволяет более точно характеризовать материал. На изображении ниже показано изображение и спектральная информация, полученные с образца свежей ткани животного, помещенного на конвейерную ленту в лаборатории с использованием гиперспектрального формирователя изображений:
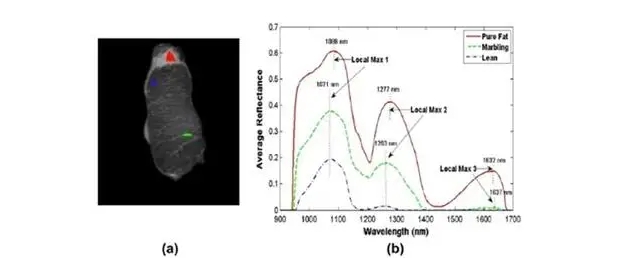
Спектрограммы различных областей: (а) маркированные области чистого жира, мраморности и чисто постных частей на образцах тканей; (б) Спектрограммы, маркированные в различных областях диаграммы (а).
Кроме того, мы можем предоставить интуитивно понятные программы для анализа изображений, классификации и визуализации различных веществ с уникальными спектральными характеристиками. Независимо от того, получены ли эти данные с воздуха, с земли или в лаборатории, вы можете увидеть на экране компьютера детали, которые могут быть неразличимы глазом.
- Категория: Блог
- Просмотров: 205
Аннотация: В этой статье подробно рассматривается широкое применение технологии гиперспектральной визуализации в области сельского хозяйства. В ней подробно рассматривается ее важная роль в мониторинге урожая, анализе почвы и тестировании качества сельскохозяйственной продукции, анализируются преимущества и проблемы этой технологии, а также рассматриваются перспективы ее будущего развития.
I. Введение
Сельское хозяйство, как базовая отрасль национальной экономики, имеет решающее значение для обеспечения продовольственной безопасности и содействия экономическому развитию. С непрерывным развитием науки и техники технология гиперспектральной съемки принесла новые возможности развития в сельскохозяйственную сферу с ее уникальными преимуществами. Гиперспектральные изображения могут предоставить богатую спектральную информацию и пространственную информацию, обеспечивая мощную техническую поддержку для реализации точного земледелия.
II. Обзор технологии гиперспектральной визуализации
(I) Принцип
Гиперспектральные изображения состоят из серии непрерывных узкополосных изображений. Измеряя отражение, излучение и другие характеристики целевого объекта на разных длинах волн, получается кривая спектральной характеристики цели. Эти кривые спектральной характеристики отражают физические, химические и другие характеристики цели и могут использоваться для идентификации и классификации цели.
(II) Характеристики
Высокое спектральное разрешение: он может различать крошечные спектральные различия и проводить тонкие различия между культурами и компонентами почвы в разных состояниях роста.
Многополосная информация: он содержит большое количество полос и может полностью получать спектральную информацию цели.
Объединение пространственной информации со спектральной информацией: можно не только определить местоположение цели, но и глубоко понять ее внутренние характеристики.
Бесконтактное измерение: мониторинг можно проводить, не влияя на рост культуры.
III. Применение гиперспектральных изображений в сельском хозяйстве
(I) Мониторинг посевов
Мониторинг состояния роста: анализируя спектральные характеристики посевов, можно отслеживать рост посевов в режиме реального времени, например, индекс площади листьев, биомассу и т. д. Например, на разных стадиях роста спектральная кривая посевов будет меняться, и эти изменения можно использовать для оценки состояния здоровья и прогресса роста посевов.
Обнаружение вредителей и болезней: вредители и болезни могут вызывать изменения в спектральных характеристиках посевов. Технология гиперспектральной визуализации позволяет быстро и точно определять область распространения и серьезность вредителей и болезней. Своевременно принимать превентивные меры для сокращения потерь.
Мониторинг водного стресса: нехватка воды влияет на физиологическое состояние посевов, тем самым изменяя их спектральные характеристики. Гиперспектральные изображения можно использовать для контроля состояния влажности посевов и обеспечения основы для разумного орошения.
(II) Анализ почвы
Обнаружение компонентов: содержание органических веществ, азота, фосфора, калия и других питательных веществ в почве можно анализировать для предоставления данных для оценки плодородия почвы и точного внесения удобрений.
Текстурный анализ: спектральные характеристики могут использоваться для определения типа текстуры почвы, например, песчаная почва, суглинок, глина и т. д., что обеспечивает эталон для улучшения почвы в сельскохозяйственном производстве.
Обнаружение загрязнения: может обнаруживать загрязняющие вещества, такие как тяжелые металлы и остатки пестицидов в почве, предоставляя технические средства для защиты окружающей среды почвы.
(III) Определение качества сельскохозяйственной продукции
Оценка зрелости: сельскохозяйственные продукты разной зрелости имеют разные спектральные характеристики. Технология гиперспектральной визуализации может точно оценить зрелость сельскохозяйственной продукции и обеспечить основу для своевременного сбора.
Оценка качества: качество сельскохозяйственной продукции может быть оценено, например, по сладости, кислотности, твердости и другим показателям фруктов, для увеличения добавленной стоимости сельскохозяйственной продукции.
Определение подлинности: для некоторых ценных сельскохозяйственных продуктов, таких как китайские лекарственные материалы, технология гиперспектральной визуализации может использоваться для определения подлинности с целью защиты прав и интересов потребителей.

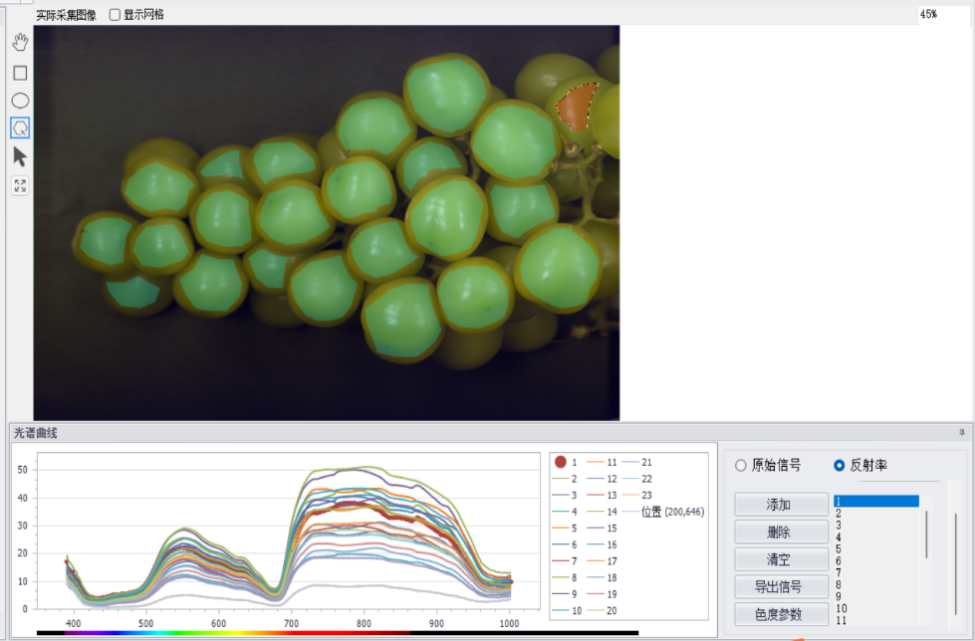
IV. Преимущества и проблемы применения технологии гиперспектральной съемки в сельском хозяйстве
(I) Преимущества
Высокая точность: может предоставлять обширную информацию и осуществлять точный мониторинг и анализ сельскохозяйственных целей.
Высокая эффективность: может быстро получать сельскохозяйственную информацию по большой площади и повышать эффективность управления сельскохозяйственным производством.
Неразрушающий контроль: бесконтактный метод измерения, который не наносит вреда посевам и почве.
(II) Проблемы
Сложная обработка данных: гиперспектральные изображения содержат большой объем данных и их трудно обрабатывать, требуя профессионального программного обеспечения и алгоритмов.
Высокая стоимость: оборудование для гиперспектральной съемки стоит дорого, что ограничивает его широкое применение в сельскохозяйственной сфере.
Проблемы адаптации к окружающей среде: качество гиперспектральных изображений может ухудшаться в различных условиях окружающей среды, таких как освещение и климат.
V. Перспективы дальнейшего развития
Непрерывный технологический прогресс: с непрерывным развитием сенсорных технологий, алгоритмов обработки данных и т. д. технология гиперспектральной визуализации станет более зрелой и совершенной, а ее производительность будет продолжать улучшаться.
Снижение затрат: с популяризацией технологий и усилением рыночной конкуренции ожидается, что цена оборудования для гиперспектральной визуализации будет постепенно снижаться, что сделает его более широко используемым в сельскохозяйственной сфере.
Интеграция нескольких технологий: объединение технологии гиперспектральной визуализации с другими передовыми технологиями, такими как технология беспилотников и технология Интернета вещей, для достижения более интеллектуального управления сельскохозяйственным производством.
Расширение области применения: в дополнение к текущим областям применения технология гиперспектральной визуализации также будет играть важную роль в сельскохозяйственном страховании, оценке сельскохозяйственных ресурсов и других областях.
VI. Заключение
Технология гиперспектральной визуализации имеет широкие перспективы применения в сельскохозяйственной сфере. Она обеспечивает точные и эффективные средства для мониторинга урожая, анализа почвы и тестирования качества сельскохозяйственной продукции. Хотя все еще существуют некоторые проблемы, с непрерывным развитием технологий и снижением затрат технология гиперспектральной визуализации будет играть все более важную роль в сельскохозяйственной сфере и вносить больший вклад в содействие модернизации сельского хозяйства.
- Категория: Блог
- Просмотров: 221
Аннотация: Технология гиперспектральных изображений, как передовая технология дистанционного зондирования, достигла значительного развития и широкого применения во многих областях в последние годы. В этой статье подробно излагаются принципы и характеристики гиперспектральных изображений, подробно обсуждаются их применение в сельском хозяйстве, мониторинге окружающей среды, геологоразведке и других областях, а также рассматриваются будущие тенденции развития.
1. Введение
С непрерывным развитием науки и техники технология гиперспектральных изображений играет все более важную роль во многих областях благодаря своим уникальным преимуществам. Гиперспектральные изображения могут не только предоставлять богатую пространственную информацию, но и получать точную спектральную информацию, обеспечивая надежную поддержку для идентификации целей, классификации и количественного анализа.
2. Принципы и характеристики гиперспектральных изображений
(1) Принцип
Гиперспектральные изображения состоят из серии непрерывных узкополосных изображений, каждая полоса соответствует разному диапазону длин волн. Измеряя отражение, излучение и другие характеристики целевого объекта на разных длинах волн, можно получить кривую спектральной характеристики цели. Эти кривые спектральной характеристики содержат физическую, химическую и другую характерную информацию о цели и могут использоваться для идентификации и классификации цели.
(2) Особенности
Высокое спектральное разрешение: позволяет различать небольшие спектральные различия и предоставлять более богатую спектральную информацию.
Многополосная информация: содержит десятки или даже сотни полос, которые могут всесторонне отражать характеристики цели.
Сочетание пространственной информации и спектральной информации: позволяет не только получить пространственное распределение цели, но и понять ее спектральные характеристики.
Бесконтактное измерение: нет необходимости контактировать с целевым объектом, можно осуществлять мониторинг на большом расстоянии и большой площади.
3. Применение гиперспектральных изображений в различных областях
(1) Сельскохозяйственное поле
Мониторинг посевов: он может контролировать состояние роста посевов, вредителей и болезней и т. д., а также оказывать поддержку принятию решений для точного земледелия. Например, анализируя спектральные характеристики посевов, можно оценить состояние питания посевов, а также своевременно проводить удобрение и орошение.
Анализ почвы: он может быстро определять состав почвы, плодородие и т. д., обеспечивая основу для улучшения почвы и рационального внесения удобрений.
Тестирование качества сельскохозяйственной продукции: его можно использовать для определения зрелости, качества и других показателей сельскохозяйственной продукции для повышения качества и рыночной конкурентоспособности сельскохозяйственной продукции.
(2) Область мониторинга окружающей среды
Мониторинг качества воды: анализируя спектральные характеристики водоемов, можно обнаружить содержание загрязняющих веществ и рост водорослей в воде для оказания технической поддержки по защите водных ресурсов.
Атмосферный мониторинг: его можно использовать для мониторинга концентрации загрязняющих веществ, распределения аэрозолей и т. д. в атмосфере, а также для предоставления данных для оценки качества атмосферной среды.
Мониторинг экологической среды: он может контролировать растительный покров, биоразнообразие и т. д., а также предоставлять научную основу для защиты экологической среды и устойчивого развития.
(3) Область геологоразведки
Разведка полезных ископаемых: гиперспектральные изображения можно использовать для определения спектральных характеристик различных минералов и быстрого и точного исследования полезных ископаемых.
Мониторинг геологических катастроф: он может отслеживать геологические катастрофы, такие как оползни и селевые потоки, для предоставления информации для раннего предупреждения и предотвращения катастроф.
4. Тенденции развития технологии гиперспектральной съемки
(1) Более высокое спектральное разрешение и пространственное разрешение: с непрерывным развитием технологий спектральное разрешение и пространственное разрешение гиперспектральных изображений будут продолжать улучшаться, что позволит предоставлять более точную информацию о цели.
(2) Мониторинг в реальном времени и быстрая обработка: разработка технологии мониторинга в реальном времени для достижения быстрого реагирования и обработки целей и повышения своевременности мониторинга.
(3) Слияние данных из нескольких источников: слияние гиперспектральных изображений с другими данными дистанционного зондирования, географическими информационными данными и т. д. для повышения точности распознавания и классификации целей.
(4) Интеллектуальное применение: объединение искусственного интеллекта, машинного обучения и других технологий для реализации автоматического анализа и обработки гиперспектральных изображений и повышения эффективности работы.
5. Заключение
Как передовая технология с широкими перспективами применения, технология гиперспектральных изображений играет важную роль в сельском хозяйстве, мониторинге окружающей среды, геологоразведке и других областях. С непрерывным развитием и совершенствованием технологий технология гиперспектральных изображений будет широко использоваться в большем количестве областей и вносить больший вклад в развитие и прогресс человеческого общества.
- Категория: Блог
- Просмотров: 246
Аннотация: В данной статье подробно рассматриваются важные применения технологии гиперспектральной визуализации в области мониторинга окружающей среды. От мониторинга качества воды, атмосферного мониторинга до мониторинга экологической среды анализируются уникальные преимущества, методы применения и проблемы гиперспектральной визуализации, а также прогнозируются тенденции ее будущего развития.
I. Введение
С ростом значимости экологических проблем точный и эффективный мониторинг окружающей среды стал главным приоритетом. Технология гиперспектральной визуализации с ее высоким спектральным разрешением и многополосной информацией является мощным инструментом для мониторинга окружающей среды. Она может получать подробные спектральные характеристики целевых объектов и обеспечивать научную основу для оценки качества окружающей среды и контроля загрязнения.
II. Обзор технологии гиперспектральной визуализации
(I) Принцип
Гиперспектральные изображения состоят из множества непрерывных узкополосных изображений. Измеряя отражение, излучение и другие характеристики цели на разных длинах волн, получается кривая спектральной характеристики цели. Эти кривые содержат физическую и химическую информацию о цели и могут использоваться для идентификации и анализа различных элементов окружающей среды.
(II) Характеристики
Высокое спектральное разрешение: позволяет различать тонкие спектральные различия и точно идентифицировать различные вещества в окружающей среде.
Многополосная информация: содержит большой объем данных о полосах, которые могут полностью отражать характеристики экологических целей. Объединение пространственной информации со спектральной информацией: можно не только определить местоположение экологических целей, но и глубоко понять их состав и состояние.
Бесконтактное измерение: мониторинг можно проводить без нанесения вреда окружающей среде.
III. Применение гиперспектральных изображений в мониторинге окружающей среды
(I) Мониторинг качества воды
Обнаружение загрязняющих веществ: может обнаруживать различные загрязняющие вещества в воде, такие как тяжелые металлы, органические вещества, питательные вещества и т. д. Различные загрязняющие вещества будут иметь уникальные спектральные реакции на определенных длинах волн. Анализируя гиперспектральные изображения, можно точно определить типы и концентрации загрязняющих веществ.
Мониторинг водорослей: рост водорослей вызовет изменения в спектральных характеристиках водоемов. Технология гиперспектральной визуализации может контролировать распределение и состояние роста водорослей в режиме реального времени, обеспечивая поддержку предупреждению о цветении воды.
Оценка качества воды: путем интеграции информации из нескольких диапазонов можно провести комплексную оценку качества воды, включая такие показатели, как прозрачность, мутность и растворенный кислород.
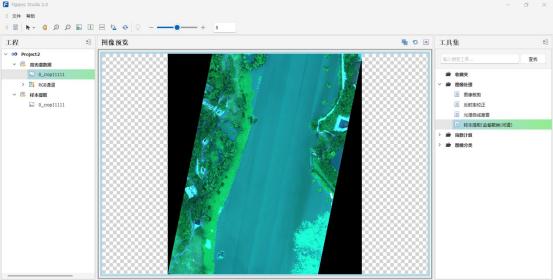
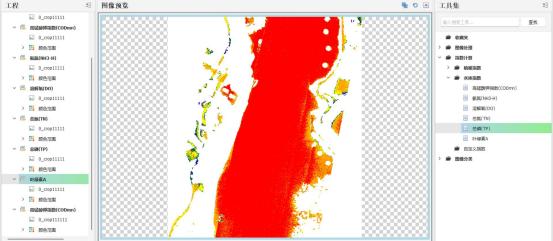
(II) Мониторинг атмосферы
Мониторинг концентрации загрязняющих веществ: он может контролировать различные загрязняющие вещества в атмосфере, такие как диоксид серы, оксиды азота и озон. Анализируя гиперспектральные изображения атмосферы, можно получить распределение концентрации и тенденции изменения загрязняющих веществ.
Мониторинг аэрозолей: аэрозоли оказывают важное влияние на атмосферную среду и изменение климата. Технология гиперспектральной визуализации может идентифицировать различные типы аэрозолей и контролировать их концентрацию и распределение.
Мониторинг парниковых газов: мониторинг парниковых газов, таких как диоксид углерода и метан, для предоставления данных для реагирования на изменение климата.
(III) Мониторинг экологической среды
Мониторинг растительного покрова: анализируя спектральные характеристики растительности, можно точно рассчитать растительный покров и оценить здоровье экосистемы.
Мониторинг биоразнообразия: разные виды имеют разные спектральные характеристики. Технология гиперспектральной визуализации может использоваться для выявления и мониторинга биоразнообразия и обеспечения основы для экологической защиты.
Мониторинг изменений в землепользовании: он может быстро отслеживать изменения в землепользовании и оперативно обнаруживать незаконное занятие и экологический ущерб.
IV. Преимущества и проблемы применения технологии гиперспектральной съемки в области мониторинга окружающей среды
(I) Преимущества
Высокоточный мониторинг: он может предоставлять подробную спектральную информацию для достижения высокоточного мониторинга и анализа экологических целей.
Мониторинг большой площади: он может быстро получать экологическую информацию на большой площади и повышать эффективность мониторинга.
Мониторинг в реальном времени: он имеет возможность мониторинга в реальном времени и может оперативно отражать изменения в окружающей среде.
(II) Проблемы
Сложная обработка данных: гиперспектральные изображения содержат большой объем данных и сложны в обработке, требуя профессионального программного обеспечения и алгоритмов.
Вмешательство окружающей среды: при реальном мониторинге окружающей среды на него легко влияют такие факторы, как погода и свет, что снижает точность данных.
Высокая стоимость оборудования: оборудование для гиперспектральной съемки является дорогостоящим, что ограничивает его широкое применение в области мониторинга окружающей среды.
V. Тенденции будущего развития
Технологические инновации: Постоянное улучшение разрешения и точности гиперспектральных изображений, разработка более совершенных алгоритмов обработки данных и повышение точности и эффективности мониторинга.
Объединение данных из нескольких источников: Интеграция гиперспектральных изображений с другими данными мониторинга окружающей среды, такими как данные спутникового дистанционного зондирования и данные наземного мониторинга, для достижения более комплексного мониторинга окружающей среды.
Интеллектуальное применение: Объединение искусственного интеллекта, машинного обучения и других технологий для достижения автоматического анализа и обработки гиперспектральных изображений и повышения уровня интеллектуальности мониторинга.
Снижение затрат: Ожидается, что с развитием технологий и расширением рынка стоимость оборудования для гиперспектральной съемки будет постепенно снижаться, что будет способствовать его широкому применению в области мониторинга окружающей среды.
VI.Заключение
Технология гиперспектральной визуализации имеет большой потенциал применения в области мониторинга окружающей среды. Она предоставляет новые средства и методы для мониторинга качества воды, атмосферного мониторинга и мониторинга экологической среды. Хотя все еще существуют некоторые проблемы, с постоянным развитием и совершенствованием технологий технология гиперспектральной визуализации будет играть все более важную роль в мониторинге окружающей среды и оказывать сильную поддержку защите окружающей среды и достижению устойчивого развития.
Страница 4 из 30
